La afinidad eléctrica, afinidad electrónica o AE
Es la energía intercambiada cuando un átomo neutro, gaseoso, y en su estado fundamental, capta un electrón y se convierte en un ión mononegativo
La afinidad electrónica es la cantidad de energía absorbida por un átomo aislado en fase gaseosa para formar un ión con una carga eléctrica de −1. Si la energía no es absorbida, sino liberada en el proceso, la afinidad electrónica tendrá, en consecuencia, valor negativo tal y como sucede para la mayoría de los elementos químicos; en la medida en que la tendencia a adquirir electrones adicionales sea mayor, tanto más negativa será la afinidad electrónica. De este modo, el flúor es el elemento que con mayor facilidad adquiere un electrón adicional, mientras que el mercurio es el que menos.
La afinidad electrónica es la cantidad de energía absorbida por un átomo aislado en fase gaseosa para formar un ión con una carga eléctrica de −1. Si la energía no es absorbida, sino liberada en el proceso, la afinidad electrónica tendrá, en consecuencia, valor negativo tal y como sucede para la mayoría de los elementos químicos; en la medida en que la tendencia a adquirir electrones adicionales sea mayor, tanto más negativa será la afinidad electrónica. De este modo, el flúor es el elemento que con mayor facilidad adquiere un electrón adicional, mientras que el mercurio es el que menos.
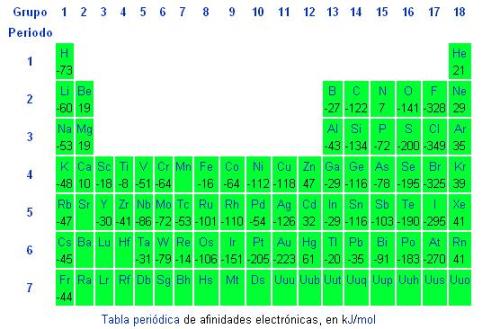
Aunque la afinidad electrica parece variar de forma caótica y desordenada a lo largo de la tabla periódica, se pueden apreciar patrones. Los no metales tienen afinidades electrónicas más bajas que los metales, exceptuando los gases nobles que presentan valores positivos por su estabilidad química, ya que la afinidad electrónica está influenciada por la regla del octeto.
Los elementos del grupo 1, tienden a ganar un electrón y formar aniones −1, completando el subnivel s, mientras que los elementos del grupo 2, que ya lo tienen completo, no presentan esa tendencia. Análogamente sucede en el bloque p, donde las afinidades electrónicas se van haciendo más negativas a medida que nos acercamos a los gases nobles.
Existen átomos que presentan capas de valencia con lugares vacantes o "huecos", que pueden ser ocupados por electrones.
Entonces cuando a un átomo neutro se le añaden uno o más electrones se presenta un desprendimiento de energía, conocida como afinidad electrica, obteniéndose como resultado la formación de aniones.
Aunque la magnitud de dicha energía liberada sólo puede determinarse indirectamente y muy rara vez con gran exactitud, en la tabla periódica la podemos predecir en orden ascendente en un mismo período, de izquierda a derecha, y en un mismo grupo, de abajo hacia arriba.
La Afinidad Electrónica o Electroafinidad (AE)
es la energía que se desprende cuando un átomo neutro en estado gaseoso captura un electrón para convertirse en un ion negativo:
siendo A un átomo neutro cualquiera.
La Afinidad Electrónica es la propiedad inversa de la Energía de Ionización (energía necesaria para arrancar un electrón a un átomo neutro).
Medida de la Afinidad Electrónica:
La Afinidad Electrónica se puede medir en:
es la energía que se desprende cuando un átomo neutro en estado gaseoso captura un electrón para convertirse en un ion negativo:
siendo A un átomo neutro cualquiera.
La Afinidad Electrónica es la propiedad inversa de la Energía de Ionización (energía necesaria para arrancar un electrón a un átomo neutro).
Medida de la Afinidad Electrónica:
La Afinidad Electrónica se puede medir en:
- Electrón-voltios por átomo (eV/átomo)
- Kilojulios por mol (KJ/mol)
Propiedades de la Afinidad Electrónica:
- Afinidad Electrónica negativa (se desprende energía): se da cuando los átomos adquieren una configuración más estable al captar un electrón por lo que predominará la fuerza atractiva. Esto se da por ejemplo en los halógenos que al ganar un electrón adquieren la configuración electrónica de Gas Noble (estable)
- Afinidad Electrónica positiva (se absorve energía): se da cuando hay que proporcionar energía al átomo para captar al ion. Esto le sucede por ejemplo a los elementos con configuración electrónica s2 ya que el electrón tendría que incorporarse al orbital p de mucha mayor energía como es el caso del Berilio, del Magnesio o del Calcio.
- La Afinidad Electrónica normalmente presenta un valor negativo
- La Afinidad Electrónica aumenta hacia la derecha en un mismo Periodo de la Tabla Periódica debido a que al disminuir el Radio Atómico, el nuevo electrón estará más cerca del núcleo y por consiguiente será atraído con más fuerza
- La Afinidad Electrónica aumenta hacia arriba en un mismo Grupo o Columna de la Tabla Periódica debido a que el Radio Atómico será menor y el nuevo electrón será atraído con más fuerza
- Varía en el mismo sentido que la Energía de Ionización y de la Electronegatividad y en sentido contrario al Radio Atómico
- Las mayores Afinidades Electrónicas las presentan los Halógenos (Flúor, Cloro, Bromo, Iodo)
- El Nitrógeno presenta una anomalía ya que su afinidad electrónica es mucho menor que los elementos vecinos de la Tabla Periódica debido a que por su configuración electrónica es muy estable.
- No se puede medir directamente la afinidad electrónica sino a través de métodos indirectos. Es por esta razón que solamente se conocen los valores de Afinidad Electrónica de un número relativamente pequeño de elementos.




no se calla ese sonido
ResponderEliminarese violin casi me da un infarto
ResponderEliminar