Energía de Ionización:
La Energía de Ionización Ei (también llamada Potencial de Ionización) es laenergía necesaria para arrancar el electrón más externo de un elemento en estado gaseoso:
A(g) + Ei → A+(g) + e-
- A(g) es un elemento cualquiera en estado gas
- A+(g) ion del elemento al que se le arranca un electrón
Medida de la Energía de Ionización:
La Energía de Ionización se puede medir en:
- Electrón-voltios por átomo (eV/átomo)
- Kilocalorías por mol (kcal/mol)
- Kilojulios por mol (KJ/mol)
- Potencial de ionización: es el potencial en voltios (V) necesario para arrancar el electrón
Nota: 1 eV = 1,6 × 10-19 J
 |
| Energías de Ionización (kJ/mol) |
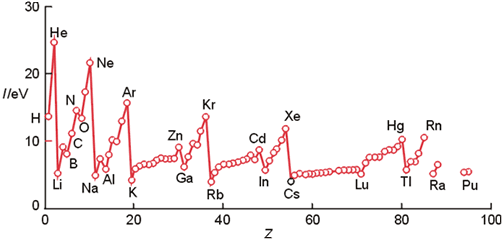
Propiedades de la Energía de Ionización:
- Radio Atómico: la Energía de Ionización varía inversamente con el Radio atómico, puesto que cuanto más pequeño sea el radio atómico, más alta será la atracción del núcleo sobre el electrón
- La Ei aumenta de izquierda a derecha en la Tabla Periódica al disminuir el radio atómico
- La Ei aumenta de abajo arriba en la Tabla Periódica al estar el último electrón en capas más cercanas al núcleo
- Segunda Energía de Ionización: es mayor que la primera ya que la fuerza electrostatica que soporta el electrón es mayor: Ei (A+→A+2) > Ei (A → A+). Asimismo la tercera energía de ionización sería también mayor y así sucesivamente.
- Apantallamiento: los electrones de capas inferiores pueden interferir sobre el electrón exterior (efecto pantalla) produciendo irregularidades en le Energía de Ionización.
Por estas razones, se comprueba que:
- Alcalinos: Los elementos alcalinos (Primer Grupo o Columna) poseen la menor Energía de Ionización
- Gases Nobles: poseen la mayor Energía de Ionización ya que su última capa está completa (configuración electrónica estable)
- Grupo del Boro: los elementos de este grupo (Boro, Aluminio, Galio, Indio y Talio) presentan una anomalía a las reglas anteriores ya que su valor es inferior. Esto es debido a que en este grupo comienzan a rellenarse los orbitales p (menos atraidos al núcleo que los s)
- Grupo del Oxígeno: también presentan una Energía de Ionización ligeramente menor debido en este caso a un efecto de repulsión entre electrones que ocupan un mismo orbital p
La facilidad con la que se puede separar un electrón de un átomo se mide por su energía de ionización, que se define como la energía mínima necesaria para separar un electrón del átomo en fase gaseosa:
A(g) → A+(g) + e-(g) ΔH = I1
La primera energía de ionización, I1, es la que se requiere para arrancar el electrón más débilmente unido al átomo neutro en estado 2, corresponde a la ionización del catión resultante, y así sucesivamente. Las energías de ionización se expresan en electrones-voltios (eV), donde 1 eV es la energía que adquiere un electrón cuando atraviesa una diferencia de potencial de 1V. 1eV equivale a 96,487 kJ mol-1.
gaseoso; la segunda energía de ionización, I





Publicar un comentario